| J Korean Biol Nurs Sci > Volume 25(4); 2023 > Article |
|
Abstract
Purpose
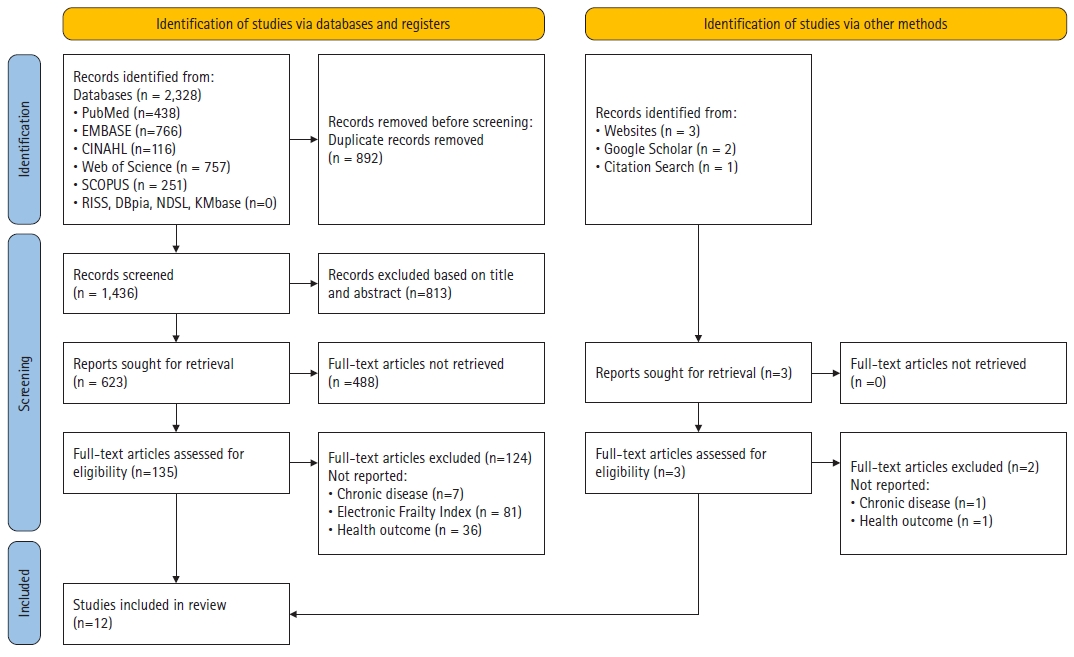
Methods
Results
Notes
AUTHORSHIP
JWS and YJS contributed to the conception and design of this study; JWS collected data; JWS and MYY performed the statistical analysis and interpretation; JWS and MYY drafted the manuscript; JWS, MYY and YJS critically revised the manuscript; JWS and YJS supervised the whole study process. All authors read and approved the final manuscript.
Table 1.
SD = standard deviation; m = male; f = female; AF = atrial fibrillation; BP = blood pressure; CCI = Charlson Comorbidity Index; CHA2DS2-Vasc = atrial fibrillation stroke score; CHD = coronary heart disease; CKD = chronic kidney disease; COPD = chronic obstructive pulmonary disease; DBP = diastolic blood pressure; eFI = electronic frailty index; eFRAGICAP = electronic frailty index, primary healthcare centres, Catalunya; EHRs = electronic health records; HF = heart failure; NHS = National Sealth Service; MI = myocardial infarction; OAC = oral anticoagulation; SBP = systolic blood pressure; THA = total hip arthroplasty; UK = United Kingdom; USA = United States of America.
Table 2.
Table 3.
CI = confidence interval; CV = cardiovascular; ED = emergency department; GI = gastrointestinal; GP = general practitioner; IADL = instrumental activities of daily living; IRR = incidence rate ratio; HR = hazard ratio; LOS = length of stay; MI = myocardial infarction; NH = nursing home; OR = odds ratio; THR = total hip replacement.
REFERENCES
Appendices
Appendix.
Studies included in systematic review
-
METRICS

-
- 0 Crossref
- 0 Scopus
- 918 View
- 50 Download
- ORCID iDs
-
Jung-Wook Shin

https://orcid.org/0009-0009-9511-4441Min-Young Yu

https://orcid.org/0000-0002-1616-606XYoun-Jung Son

https://orcid.org/0000-0002-0961-9606 - Related articles



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print